| جوانيدين | |
|---|---|
| الخواص | |
| الصيغة الجزيئية | CH₅N₃[1] |
| نقطة الانصهار | 50 درجة حرارة مئوية |
| المعرفات | |
| CAS | 113-00-8 |
| بوب كيم | 3520 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
جوانيدين (بالإنجليزية: Guanidine) هو مركب كيميائي صلب عديم اللون يتفكك بالمذيبات القطبية، صيغته الكيميائية هي HNC(NH2)2، وهوعبارة عن قاعدة قوية، يستخدم في صناعات البلاستك والمتفجرات، وهو ناتج طبيعي لعملية أيض البروتين ويمكن ملاحظته بالبول. يظهر الجسم الكيميائي الأكبر للجوانادين في العديد من المركبات العضوية الكبيرة ومنها السلسلة الطرفية للأرجنين.
الهيكل الكيميائي
يُنظر للجوانيدين كنظير نيتروجيني من حمض الكرونيك وذلك بتبديل جزء ال C=O في حمض الكربونيك بـ C=NH واستبدال كل مجموعة هيدوكسيد OH بمجموعة NH2[3] ويمكن النظر للـ إيزوبوتيلين بنفس الطريقة كنظير كربوني. وبالرغم من بساطة المركب فقد ظهر أول تحليل دقيق لصورة الأشعة السينية للجوانيدين بعد 148 عاما من تصنيعه لأول مرة[4]، حُددت أماكن ذرات النيتروجين واهتزازيهم الجزئي عام 2013 تقنية البلورة الأحادية والحيود حول ذرات النايتروجين.[5]
الإنتاج
يمكن الحصول على الجوانيدين من المصادر الطبيعية، وأول من استطاع عزله الكيميائي لألماني أدولف شتريكر بانحلال الجوانين.[6] صنع لأول مرة عام 1861 عن طريق الانحلال المؤكسد للمركب العطري الطبيعي جوانين المعزول من فضلات الطيور.[7]
يصنع مخبريا عن طريق التحلل الحراري لثيوسيانات الأمونيوم في ظروف لامائية على درجة حرارة 180-190س° :
التصنيع التجاري يتمضن خطوتين، بدأً بتفاعل ثنائي سيانوجوانادين مع أملاح الأمونيوم مع العامل المساعد (بيجوانايد)، تفكك أملاح الأمونيوم يوفر الأملاح لمركب الجوانيدينيوم الموجب. في الخطوة الثانية يعالج الملح بقاعدة مثل ميثوكسيد الصوديوم.
خواص كيميائية
الجوانيدينيوم الموجب
قيمة الpKb لمركب الجوانيدين 0.4 مما يعني أنه مركب عالي القاعدية وبالتالي معظم مشتقات الجوانيدين هي عبارة عن ملح مع حمضه المرافق.
الحمض المرافق يسمى الجوانيدينيوم الموجب (C(NH2)+3) وهو مركب مستوي متماثل الأطراف يتكون من ثلاث مجموعات أمينية مرتبطة بذرة الكربون المركزية برابطة تساهمية. وهو مستقر في المحاليل المائية نتيجة الرنين الفعال للشحنة والتذواب الفعال لجزيئات الماء. قيمة ال pKaH للمركب هي 13.6[8] وتعني أنه قاعدة قوية بالماء. يتواجد أيون الجوانيدين بالماء المتعادل بشكل جوانيدينيوم حصريا.
-
الأشكال المتعارف عليها
كاشف الجوانيدينيوم
يمكن انتقاء جوانيدينيوم باستخدام صوديوم 1,2-نفثوكينون-4-حمض السلفونيك (كاشف فولين) واليوريا المحمضة.[9]
استخدامات
الصناعة
ملح الجوانيدين المستخدم تجاريا هو نايتروجينات الجوانيدين C(NH2)3]NO3] ويستخدم كغاز دافع كما هو الحال بالوسائد الهوائية.
الكيمياء الحيوية
يتواجد الجوانيدين في الكائنات الحية بشكله المهدرج كالجوانيدينيوم.
كلوريد الجوانيدينيوم يستخدم لإفساد وتغير شكل البروتينات، تزداد قوته في تفكيك البروتينات وافسادها بالزدياد تركيزه، فمثلا في محلول ذا تركيز مولي 6 كلوريد جوانيدينيوم كل البروتينات تفقد بنيتها الحيوية تقريبا ليبقى فقط سلاسل ببتدية عشوائية ملتفة حول بعضها.
استخدم كلوريد الجوانيدينيوم أيضا كمعزز علاج في التسمم السجقي عام 1968[10]، لكن الآن أصبح الأمرخلافي لأنه بعض المرضى لم يظهروا أي تحسن بعد استخدمه.[11][12] وهو المادة الفعالة في بعض منعمات الشعر.
ثيوسيانات الجوانيدينيوم أيضا استخدمت لخصائصها المفسدة في مختلف العينات البيولوجية.
مشتقات الجوانيدين
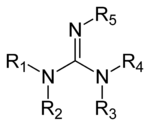
مجموعة من المركبات العضوية يتشاركون مجموعة وظيفية معينة وصيغة كيميائية عامة (R1R2N)(R3R4N)C=N−R5 والرابطة المركزية، وهي إيمين، وتكون قريبة هيكليا من الأميدينات واليوريا.
بعض الأمثلة على مشتقات الجوانيدين: أرجنين وتريازابيسكلوديسين وساكسيتوكسين وكرياتين.[13]
انظر أيضًا
المراجع
- ^ ا ب ج د guanidine (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Göbel, Michael; Klapötke, Thomas M. (25 Jul 2007). "First structural characterization of guanidine, HNC(NH2)2". Chemical Communications (بالإنجليزية) (30): 3180–3182. DOI:10.1039/B705100J. ISSN:1364-548X. Archived from the original on 2020-02-27.
- ^ Yamada, Takahiro; Liu, Xiaohui; Englert, Ulli; Yamane, Hisanori; Dronskowski, Richard (2009). "Solid-State Structure of Free Base Guanidine Achieved at Last". Chemistry – A European Journal (بالإنجليزية). 15 (23): 5651–5655. DOI:10.1002/chem.200900508. ISSN:1521-3765. Archived from the original on 2021-07-15.
- ^ Sawinski، Peter Klaus؛ Meven، Martin؛ Englert، Ulli؛ Dronskowski، Richard (3 أبريل 2013). "Single-Crystal Neutron Diffraction Study on Guanidine, CN3H5". Crystal Growth & Design. ج. 13 ع. 4: 1730–1735. DOI:10.1021/cg400054k. ISSN:1528-7483. مؤرشف من الأصل في 2023-02-13.
- ^ Thomas; Mertschenk, Bernd; Schulz, Bernd (2006). Ullmann's Encyclopedia of Industrial Chemistry (بالإنجليزية). American Cancer Society. DOI:10.1002/14356007.a12_545.pub2. ISBN:978-3-527-30673-2. Archived from the original on 2018-09-20.
- ^ Strecker، Adolph (1 يناير 1861). "Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffeïn und Kreatinin". DOI:10.1002/jlac.18611180203. مؤرشف من الأصل في 2021-07-16.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ D. D; Perrin, D. D; International Union of Pure and Applied Chemistry; Commission on Electroanalytical Chemistry (1972). Dissociation constants of organic bases in aqueous solution: supplement 1972 (بالإنجليزية). London: Butterworths. OCLC:713375. Archived from the original on 2021-07-14.
- ^ Sullivan, M. X. (1 Oct 1935). "A Colorimetric Test for Guanidine". Proceedings of the Society for Experimental Biology and Medicine (بالإنجليزية). 33 (1): 106–108. DOI:10.3181/00379727-33-8270C. ISSN:0037-9727. Archived from the original on 2021-04-27.
- ^ Kaplan, Jonathan E.; Davis, Larry E.; Narayan, Venkat; Koster, John; Katzenstein, David (1979). "Botulism, type A, and treatment with guanidine". Annals of Neurology (بالإنجليزية). 6 (1): 69–71. DOI:10.1002/ana.410060117. ISSN:1531-8249. Archived from the original on 2018-06-09.
- ^ Pediatric Anaerobic Infections : Diagnosis and Management (بالإنجليزية). CRC Press. 1 Nov 2001. DOI:10.3109/9780203904022/pediatric-anaerobic-infections-itzhak-brook. ISBN:978-0-429-20756-3. Archived from the original on 2021-07-17.
- ^ Puggiari، Marcello؛ Cherington، Michael (17 نوفمبر 1978). "Botulism and Guanidine: Ten Years Later". JAMA. ج. 240 ع. 21: 2276–2277. DOI:10.1001/jama.1978.03290210058027. ISSN:0098-7484. مؤرشف من الأصل في 2023-02-21.
- ^ Witters، Lee A. (15 أكتوبر 2001). "The blooming of the French lilac". Journal of Clinical Investigation. ج. 108 ع. 8: 1105–1107. ISSN:0021-9738. PMID:11602616. مؤرشف من الأصل في 2021-06-10.